Multifaktoriāla krūts vēža ģenētisko riska faktoru izvērtējums
Multifaktoriāla krūts vēža ģenētisko riska faktoru izvērtējums
Kopsavilkums
Krūts vēzis ir kompleksa, multifaktoriāla slimība, kurai raksturīga ārējās vides un ģenētisko riska faktoru mijiedarbība. Zemas penetrances alēliskie varianti ir aktuāls pētījumu objekts krūts vēža patoģenēzē. Ar krūts vēža attīstību saistītiem zemas penetrances variantiem ir novērots variabls sastopamības biežums un predispozīcijas efekta spēks starp dažādām populācijām. Šī pētījuma mērķis bija noteikt 11 zemas penetrances alēlisko variantu saistību ar krūts vēža attīstību Latvijas iedzīvotāju populācijā.
Pētījumā tika analizēta 2609 krūts vēža pacienšu un 694 brīvprātīgo asins donoru genomiskā DNS. Vienpadsmit alēlisko variantu genotipēšanu veica ar restrikcijas fragmentu garuma polimorfisma metodi un TaqMan zondēm. Genotipēšanas rezultāti un pieejamie klīniskie dati tika apkopoti un apstrādāti, izmantojot statistiskās apstrādes un analīzes metodes.
Statistiski ticamu asociāciju ar krūts vēža saslimšanu novēroja septiņiem no vienpadsmit analizētajiem variantiem. Pieci no tiem (rs9693444, rs1550623, rs13329835, rs3760982, rs7072776) uzrādīja krūts vēža saslimšanas risku palielinošu efektu, turpretī rs17356907 un rs1436904 – protektīvu efektu. Tika apstiprināts krūts vēža saslimšanas riska palielinošs efekts, pieaugot riska alēļu skaitam. Ticama pētījumā analizēto alēlisko variantu ietekme uz pacienšu slimības specifiskās dzīvildzes rādītājiem netika novērota.
Ievads
Krūts vēzis ir visizplatītākā ļaundabīgo audzēju lokalizācija un biežākais ar ļaundabīgajiem audzējiem saistītais nāves iemesls sievietēm gan Latvijā, gan visā pasaulē (Gardovskis, 2005; Ma, 2012). Krūts vēža saslimšanas risku nosaka ārējās vides un ģenētisko riska faktoru mijiedarbība (Lobo, 2008). Kaut arī vides faktoriem ir vadošā loma ļaundabīgo audzēju attīstībā, krūts vēzim ir novērota statistiski ticama 27 % heritabilitāte, 95 % CI = 4–41 (Lichtenstein, 2000). Izmaiņas augstas penetrances gēnos (BRCA1, BRCA2, TP53 u. c.) tiek atklātas salīdzinoši bieži, taču tās ir aptuveni 25 % pārmantotā krūts vēža gadījumu un tikai 5 % no kopējās krūts vēža predispozīcijas, jo to frekvence visā populācijā ir zema (Thompson, 2004; Berzina, 2013). Uzskata, ka atlikušo krūts vēža risku veido bieži sastopami zemas penetrances varianti ar izredžu attiecībām robežās no 1,2 līdz 1,5, to kombinācijas, kā arī ārējās vides faktori (Ledwoń, 2013). Zemas penetrances varianti ir polimorfu gēnu alēles, kas ietekmē krūts vēža saslimšanas risku. Šie alēliskie varianti ir plaši sastopami kopējā populācijā. Kaut arī katra varianta ietekme uz saslimšanas risku ir neliela, to veidotais risks populācijā tiek uzskatīts par lielāku nekā retiem augstas penetrances gēnu variantiem. Zemas penetrances variantus novēro dažādos signālceļos, kas ietekmē vides kancerogēnu detoksifikāciju, steroīdu metabolismu, atbildes reakciju uz DNS bojājumiem, imunomodulāciju, taču nereti to lokalizācija neliecina par funkcionalitāti (Martin, 2000). Vairāki pētījumi pamato poligēno krūts vēža pārmantošanas modeli, kurā saslimšanas risks palielinās, pieaugot slimības attīstību predisponējošu zemas penetrances variantu skaitam ar nelielu individuālu efektu (Pharoah, 2008; Harlid, 2012). Pilna genoma asociācijas pētījumos līdz šim ir identificēti 79 zemas penetrances varianti ar potenciālu lomu krūts vēža attīstībā, taču to sastopamības biežums un predispozīcijas efekta spēks ir variabls starp dažādām iedzīvotāju populācijām (Easton, 2007; Turnbull, 2010; Michailidou, 2013; Michailidou, 2015).
Darba mērķis
Noteikt 11 zemas penetrances alēlisko variantu saistību ar krūts vēža attīstību Latvijas iedzīvotāju populācijā.
Materiāls un metodes
Pētījumā iekļāva 2609 krūts vēža pacientes vecumā no 24 līdz 95 gadiem (vidējais vecums – 60,10 ± 12,32 gadi), kas laikposmā no 2000. gada 7. marta līdz 2014. gada 24. septembrim reģistrētas Paula Stradiņa Klīniskajā universitātes slimnīcā, Daugavpils onkoloģijas slimnīcā, Latvijas Onkoloģijas centrā un Liepājas onkoloģijas slimnīcā. Pacientes ar pierādītām ciltstēva mutācijām gēnā BRCA1 (5. eksonā c.181T>G, 11. eksonā c.4035delA un 20. eksonā c.5266dupC) un ģimenes anamnēzes datiem, kas liecina par slimības pārmantojamību, tika izslēgtas no pētāmās grupas.
Kontroles grupa tika veidota no 694 veselām sievietēm vecumā no 18 līdz 92 gadiem (vidējais vecums – 48,62 ± 19,90 gadi), kas reģistrējušās Paula Stradiņa Klīniskajā universitātes slimnīcā laikposmā no 2008. gada 27. marta līdz 2011. gada 13. oktobrim kā brīvprātīgie asins donori bez onkoloģiskām saslimšanām pieteikšanās brīdī.
Gan pacientes, gan brīvprātīgās asins donores iepriekš tika informētas par pētījuma mērķiem un iespējamiem riskiem un tika iegūts viņu rakstisks akcepts. Pētījumu veica ar Rīgas Stradiņa universitātes Ētikas komisijas atļauju.
Izmantojot reaģentu komplektu FlexiGene DNA Kit (Qiagen, Vācija), no pacienšu un brīvprātīgo donoru venozo asiņu paraugiem izolēja pētāmo DNS. Piecu alēlisko variantu noteikšanai (rs1436904, rs9693444, rs1550623, rs13329835, rs17356907) izstrādāja restrikcijas fragmentu garuma polimorfisma metodes. Sešus alēliskos variantus (rs204247, rs11571833, rs132390, rs616488, rs7072776 un rs3760982), kam nebija iespējams piemērot RFLP metodi, genotipēja ar Thermo Fisher Scientific (ASV) piedāvāto TaqMan SNP genotipēšanas reaģentu komplektu. Visas pētījumā izmantotās metodes verificēja ar Sangera sekvenēšanu. Datu statistisko apstrādi un analīzi veica statistikas programmā R 3.1.2., izmantojot šādus statistiskos testus: hī kvadrāta (χ2) testu, t testu, eksakta testu, varbūtību attiecības testu, Mantel–Haenszel testu, Kaplan–Meier analīzes metodi, Bonferroni korekciju.
Rezultāti
Visi pētījumā analizētie alēliskie varianti ir iepriekš identificēti Michailidou un kolēģu veiktajā metaanalīzē 2013. gadā un lokalizēti nekodējošos genoma reģionos (sk. 1. tab.) (Michailidou, 2013).
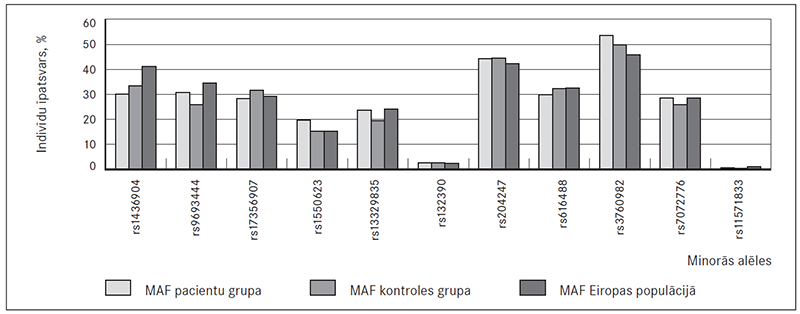
Apkopojot genotipēšanas rezultātus, novēroja atšķirīgas analizēto variantu minoro alēļu frekvences (MAF) pacienšu un kontroles grupās. Minoro alēļu frekvences kontroles grupā bija līdzīgas tām, kas novērotas Eiropas populācijā 1000 genomu projekta ietvaros un pieejamas The National Center for Biotechnology Information interneta vietnē (sk. 1. att.). Alēļu frekvenču sadalījuma atbilstību Hārdija–Veinberga vienādojumam novēroja 8 no 11 alēliskajiem variantiem, taču trīs analizētie varianti (rs1436904, rs1550623, rs3760982) uzrādīja novirzes no tā.
Tika veikta gadījuma kontroles analīze, lai noteiktu asociāciju starp alēliskajiem variantiem un saslimšanu dažādos pārmantošanas tipos: dominantā, recesīvā, kodominantā, log-aditīvā, pārmērīgi dominantā (sk. 2. tab.). Šī analīze ļauj viena alēliskā varianta ietvaros savstarpēji salīdzināt visus iespējamos genotipus dažādās kombinācijās atkarībā no analizētā ģenētiskā modeļa. Septiņi alēliskie varianti uzrādīja statistiski ticamu asociāciju ar krūts vēža attīstību: divi no tiem ar protektīvu efektu, pieci – risku palielinošu efektu. Aprēķinot veikto analīžu statistisko spēku, rs1436904, rs132390, rs204247, rs616488, rs3760982 un rs7072776 uzrādīja nepietiekošu vērtību (< 80 %).
Tika veikta padziļināta gadījuma kontroles analīze, iedalot pacientes un veselās sievietes četrās grupās pēc vecuma diagnozes brīdī (līdz 40 gadu vecumam, no 41 līdz 60 gadu vecumam, no 61 līdz 80 gadu vecumam un virs 80 gadu vecuma). Četriem alēliskajiem variantiem (rs9693444, rs17356907, rs1550623, rs7072774) novēroja spēcīgāku asociāciju ar krūts vēža saslimšanu vecuma grupā no 61 līdz 80 gadiem, turpretī rs13329835 un rs3760982 novērotais efekts bija spēcīgāks starp sievietēm līdz 40 gadu vecumam (sk. 3. tab.).
1. tabula. Pētījumā analizētie alēliskie varianti, to lokalizācija un iespējamās alēles atbilstošajos lokusos / Allelic variants analysed it the study, their localisation and possible alleles in corresponding loci
| Alēliskais variants | Lokalizācija (tuvumā esoši gēni) | Alēles* |
|---|---|---|
| rs1436904 | hr18:22824665 (CHST9 intronā) | T / G |
| rs9693444 | hr8:29509616 (RPL17P33 / LINC00589) | C / A |
| rs17356907 | hr12:94551890 (NTN4) | A / G |
| rs1550623 | hr2:173921140 (CDCA7) | A / G |
| rs13329835 | hr16:79208306 (CDYL2 intronā) | A / G |
| rs132390 | hr22:27951477 (EMID1 intronā) | T / C |
| rs204247 | hr6:13830502 (RANBP9) | A / G |
| rs616488 | hr1:10488802 (PEX14 intronā) | A / G |
| rs3760982 | hr19:48978353 (KCNN4 intronā) | G / A |
| rs7072776 | hr10:22072948 (MLLT10) | G / A |
| rs11571833 | hr13:31870626 (BRCA2 intronā) | A / T |
* Biežāk sastopamā alēle / minorā alēle.
1. attēls. Analizēto variantu minoro alēļu frekvences / Minor allele frequencies of analysed variants
2. tabula. Gadījuma kontroles analīzes rezultāti / The results of case-control analysis
| Alēliskais variants | Izredžu attiecība (OR) | Ticamības intervāls (CI) |
|---|---|---|
| rs1436904 | 0,86 | 0,75–0,99 |
| rs13329835 | 1,38 | 1,14–1,67 |
| rs132390 | 0,51 | 0,05–5,61 |
| rs204247 | 0,86 | 0,72–1,02 |
| rs616488 | 0,85 | 0,71–1,02 |
| rs3760982 | 1,34 | 1,09–1,64 |
| rs7072776 | 1,27 | 1,05–1,54 |
| rs11571833 | 1,45 | 0,60–3,47 |
| rs9693444 | 1,39 | 1,14–1,70 |
| rs17356907 | 0,69 | 0,57–0,85 |
| rs1550623 | 1,37 | 1,13–1,68 |
3. tabula. Būtiskākie gadījuma kontroles analīzes rezultāti pēc sieviešu stratifikācijas četrās vecuma grupās / The most significant results of case-control study, stratifying women in four age groups
| Alēliskais variants | Vecuma grupa, gadi | Izredžu attiecība | Ticamības intervāls | p vērtība |
|---|---|---|---|---|
| rs9693444 | 60–80 | 2,10 | 1,45–3,04 | 3,38e-05 |
| rs17356907 | 60–80 | 0,56 | 0,38–0,80 | 0,001 |
| rs1550623 | 60–80 | 1,81 | 1,20–2,80 | 0,003 |
| rs13329835 | ≤ 40 | 1,69 | 1,04–2,76 | 0,032 |
| rs3760982 | ≤ 40 | 1,87 | 1,05–3,48 | 0,027 |
| rs7072776 | 60–80 | 1,50 | 1,06–2,14 | 0,019 |
Informācija par dzīves ilgumu un nāves iemeslu bija pieejama 2364 no pētāmajā grupā iekļautajām krūts vēža pacientēm, kas reģistrējušās kopš 2000. gada. Izmantojot šos datus, aprēķināja slimības specifisko dzīvildzi 200 mēnešu periodā (16,6 gadi) no pacienšu reģistrēšanās brīža līdz nāvei krūts vēža dēļ. Nenovēroja statistiski ticamas izmaiņas dzīvildzes rādītājos starp alēlisko variantu nesējām un pacientēm ar wild-type alēlēm konkrētajos lokusos. Rs1550623 gadījumā novēroja tendenci būt labākiem slimības specifiskās dzīvildzes rādītājiem pacientēm, kuras ir alēliskā varianta nesējas homozigotiskā stāvoklī, salīdzinot ar heterozigotiskām varianta nesējām un pacientēm ar varianta wild-type formu. Līdzīgu tendenci novēroja arī starp varianta rs17356907 nesējām, taču abos gadījumos dati nesasniedza statistisko ticamību.
Veica alēlisko variantu kombināciju analīzi, atlasot piecus variantus (rs7072776, rs3760982, rs13329835, rs1550623, rs9693444) ar statistiski ticamu, krūts vēža saslimšanas risku palielinošu efektu, ko pierādīja iepriekš veiktajā gadījuma kontroles analīzē. Atlasi veica pēc šādiem kritērijiem: izredžu attiecības vērtība virs 1; ticamības intervāls neiekļauj vērtību 1; p vērtība zemāka par 0,05.
Sievietes gan no pacienšu, gan kontroles grupas klasificēja sešās kategorijās, balstoties uz iepriekš atlasīto variantu statusu un skaitu:
0. kategorija – visi atlasītie alēliskie varianti atrodas wild-type formā;
1. kategorija – viens no atlasītajiem alēliskajiem variantiem atrodas homozigotiskā vai heterozigotiskā stāvoklī;
2. kategorija – divi no atlasītajiem alēliskajiem variantiem atrodas homozigotiskā vai heterozigotiskā stāvoklī;
3. kategorija – trīs no atlasītajiem alēliskajiem variantiem atrodas homozigotiskā vai heterozigotiskā stāvoklī;
4. kategorija – četri no atlasītajiem alēliskajiem variantiem atrodas homozigotiskā vai heterozigotiskā stāvoklī;
5. kategorija – visi atlasītie alēliskie varianti atrodas homozigotiskā vai heterozigotiskā stāvoklī.
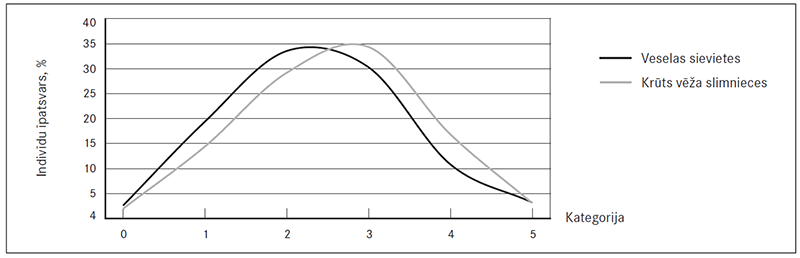
Lielāku krūts vēža pacienšu īpatsvaru novēroja trešajā kategorijā, taču kontroles grupas sievietēm – otrajā. Tas liecina par tendenci krūts vēža pacientēm būt kvantitatīvi vairāku riska alēļu nesējām nekā kontroles sievietēm, taču šī tendence nav lineāra, un gan pacienšu, gan kontroles grupas sieviešu skaits strauji samazinās, alēlisko variantu skaitam pārsniedzot vērtību trīs (sk. 2. att.).
2. attēls. Riska alēļu nesēju procentuālais daudzums kontroles un krūts vēža slimnieču grupā dažādās kategorijās atkarībā no riska alēļu skaita / The percentage of risk alleles carriers in control and breast cancer groups depending on the number of risk alleles
Visas iepriekšminētās kategorijas apvienoja divās grupās. Pirmo grupu veidoja sievietes, kas ietilpa 0., 1. un 2. kategorijā, turpretī otro grupu veidoja sievietes, kas pārstāvēja 3., 4. un 5. kategoriju, balstoties uz alēlisko variantu statusu un skaitu. Veica gadījuma kontroles analīzi, savstarpēji salīdzinot abas iepriekšminētās grupas, līdz ar to nosakot riska alēļu skaita nozīmi asociācijai ar krūts vēža saslimšanu. Rezultātā novēroja, ka sievietēm, kas ir vismaz trīs alēlisko variantu nesējas, ir statistiski ticami lielāks krūts vēža saslimšanas risks nekā tām, kam riska alēļu skaits ir mazāks par trīs (OR = 1,49; CI = 1,17–1,91; p = 0,001). Lai pārliecinātos par riska alēļu skaita ietekmi uz krūts vēža pacienšu prognozēm, salīdzināja dzīvildzes datus starp abām iepriekšminētajām grupām. Nenovēroja statistiski ticamas atšķirības slimības specifiskās dzīvildzes rādītājos 200 mēnešu periodā (p = 0,578), kas liecina, ka riska alēļu kvantitātei nav ietekmes uz krūts vēža pacienšu prognozēm.
Diskusija
Viena un tā paša alēliskā varianta asociācijas spēks ar konkrēto slimību var atšķirties starp iedzīvotāju populācijām. Tā cēlonis ir atšķirīgs sekvences variantu biežums populācijās un dažādas nelīdzsvarotās saistības struktūras. Alēliskā varianta asociācijas spēka atšķirības novēro arī starp iedzīvotāju populācijām ar kopīgu izcelsmi. Piemēram, atsevišķi šajā pētījumā analizētie alēliskie varianti uzrāda asociāciju ar krūts vēža attīstību ķīniešu populācijā, taču šī asociācija neapstiprinās Singapūras ķīniešu populācijā, liecinot par ģenētisko variabilitāti pēc izcelsmes radniecīgos indivīdos (Lee, 2014; Zhang, 2014).
Neviens no analizētajiem variantiem nav funkcionāls pēc to lokalizācijas genomā, taču izmaiņas atsevišķu gēnu sekvencēs, kas atrodas netālu no analizēto variantu lokusiem, tiek saistītas ar ļaundabīgo audzēju attīstību, liecinot par potenciālu analizēto variantu saistību ar funkcionāliem gēnu variantiem.
Pētījuma rezultāti liecina par statistiski ticamu asociāciju ar krūts vēža saslimšanu septiņiem no vienpadsmit analizētajiem variantiem Latvijas iedzīvotāju populācijā. Četri alēliskie varianti (rs132390, rs204247, rs616488, rs11571833), kuru asociācija ar krūts vēža attīstību ir apstiprināta iedzīvotāju Eiropas populācijā, mūsu pētījumā šādu saistību neuzrāda (Michailidou, 2013). Jāņem vērā, ka sešiem (rs1436904, rs132390, rs204247, rs616488, rs3760982, rs7072776) no vienpadsmit analizētajiem variantiem, kam veica gadījuma kontroles analīzi, testa statistiskais spēks nesasniedza vispārpieņemto robežvērtību – 80 %. Iespējams, šo alēlisko variantu asociācija ar slimību netiek atrasta detektēta neproporcionāla indivīdu skaita dēļ pacienšu un kontroles grupās, nevis asociācijas neesamības dēļ.
Stratificējot pacientes un kontroles sievietes četrās vecuma grupās, alēliskajiem variantiem rs13329835 un rs3760982 novēroja spēcīgāku asociāciju ar krūts vēža saslimšanas risku sievietēm līdz 40 gadu vecumam, kas liecina, ka šo variantu nesējām ir lielāka varbūtība saslimt agrākā vecumā nekā sievietēm ar variantu wild-type formām. Četriem alēliskajiem variantiem (rs9693444, rs17356907, rs1550623, rs7072774) novēroja spēcīgāku saistību ar krūts vēža saslimšanu vecuma grupā no 60 līdz 80 gadiem, kas norāda, ka šie alēliskie varianti varētu būt predisponējoši faktori krūts vēža attīstībai saistībā ar hormonālām svārstībām, jo sievietes šajā vecuma grupā visbiežāk atrodas postmenopauzes stāvoklī. Šādas hipotēzes apstiprināšanai nepieciešams veikt padziļinātu analīzi.
Pētījuma laikā nenovēroja statistiski ticamu alēlisko variantu asociāciju ar pacienšu dzīvildzes rādītājiem. Rs17356907 un rs1550623 variantu nesējām novēroja tendenci uz labākiem dzīvildzes rādītājiem, jo īpaši gadījumā, kad šie varianti pārstāvēti homozigotiskā stāvoklī, nekā pacientēm ar variantu wild-type formām, taču šie dati nesasniedza statistisko ticamību. Gadījuma kontroles analīzē rs1550623 uzrādīja krūts vēža risku palielinošu efektu, taču dzīvildzes datu analīze liecina par šī varianta tendenci uzlabot pacienšu dzīves ilguma prognozes. Rs17356907 šī pētījuma ietvaros uzrāda protektīvu efektu gan attiecībā uz krūts vēža saslimšanas risku, gan pacienšu dzīves ilguma prognozēm tendences līmenī. Kopumā tas liecina, ka zemas penetrances variantiem ir potenciāls kalpot kā prognostiskiem marķieriem, taču šīs hipotēzes apstiprināšanai nepieciešams palielināt to pacienšu skaitu, kurām ir pieejama informācija par dzīves ilgumu.
Veicot krūts vēža risku palielinošo alēļu kombināciju analīzi, noskaidroja, ka riska alēļu skaits virs trīs statistiski ticami palielina saslimšanas risku, kas liecina par zemas penetrances alēlisko variantu kvantitatīvu efektu attiecībā uz slimības attīstību. Analizējot katru alēlisko variantu atsevišķi, to asociācija ar krūts vēža saslimšanu ir pārāk vāja, lai konkrētais variants būtu lietderīgs kā ģenētiskās predispozīcijas marķieris, tāpēc, atklājot aizvien vairāk jaunu zemas penetrances riska alēļu, to efekta spēks tiek pakāpeniski palielināts, pamatojot šāda veida pētījumu nepieciešamību krūts vēža predispozīcijas noteikšanā un personalizētas medicīnas attīstībā. Pacienšu dzīvildzes datos nenovēroja atšķirības, kas varētu būt saistītas ar riska alēļu skaitu. Tas liecina, ka attiecībā uz krūts vēža pacienšu dzīves ilguma prognozēm nepastāv kvantitatīvs analizēto riska alēļu efekts, kādu novēroja saslimšanas riska gadījumā.
Pētījumā analizētie alēliskie varianti ir genotipēti arī citās iedzīvotāju populācijās. Michailidou un kolēģu veiktajā pilna genoma asociācijas pētījumā par Eiropas iedzīvotāju populāciju ir pierādīts rs9693444, rs13329835, rs3760982, rs7072776 risku palielinošais efekts un rs17356907, rs1436904 protektīvais efekts. Dati par rs1550623 asociāciju ar krūts vēža saslimšanas risku ir pretrunīgi: mūsu pētījuma laikā iegūtie rezultāti liecina, ka Latvijas iedzīvotāju populācijā šis alēliskais variants palielina krūts vēža saslimšanas risku, turpretī Michailidou un kolēģi Eiropas iedzīvotāju populācijā novēroja rs1550623 protektīvu efektu (Michailidou, 2013). Austrumāzijas iedzīvotāju populācijā ir apstiprināts rs1550623 risku palielinošais efekts un rs17356907 protektīvais efekts, taču rs13329835, rs3760982, rs7072776 un rs1436904 saistība ar krūts vēža attīstību nav novērota. Pretēji Eiropas un Latvijas iedzīvotāju populāciju datiem Austrumāzijā rs9693444 novēro protektīvu, nevis risku palielinošu efektu (Zheng, 2013). Arī ķīniešu populācijā ir apstiprināta rs17356907 protektīvā un rs9693444 risku palielinošā ietekme, taču pārējie alēliskie varianti (rs1550623, rs13329835, rs3760982, rs7072776 un rs1436904) statistiski ticamu asociāciju ar krūts vēža attīstību neuzrāda (Zhang, 2014). Singapūras ķīniešu populācijā statistiski ticama saistība ar krūts vēža attīstību netika apstiprināta nevienam no mūsu pētījumā genotipētajiem alēliskajiem variantiem (Lee, 2014). Replikatīvo pētījumu rezultāti un iegūto datu dažādība pamato zemas penetrances alēlisko variantu nozīmi krūts vēža predispozīcijā un apstiprina to variablo predispozīcijas spēku starp dažādām iedzīvotāju populācijām.
Šī pētījuma rezultāti papildina pieejamās informācijas klāstu par zemas penetrances variantu pieaugošo lomu ļaundabīgo audzēju predispozīcijā un pamato nepieciešamību turpināt multifaktoriāla krūts vēža izpēti, ņemot vērā, ka līdz šim plaši aprakstītās izmaiņas augstas penetrances gēnos izskaidro tikai nelielu proporciju krūts vēža gadījumu, kas joprojām ir viens no biežākajiem nāves iemesliem starp sievietēm visā pasaulē.
Secinājumi
- Pieci no analizētajiem variantiem (rs9693444, rs1550623, rs13329835, rs3760982, rs7072776) palielina krūts vēža risku, turpretī rs17356907 un rs1436904 ir ar protektīvu efektu.
- Sievietēm, kas ir vismaz trīs alēlisko variantu nesējas, novēro statistiski ticami lielāku krūts vēža risku nekā tām, kam riska alēļu skaits ir mazāks par trīs (OR = 1,49; CI = 1,17–1,91; p = 0,001).
- Pētījumā analizētajiem alēliskajiem variantiem nav statistiski ticamas ietekmes uz pacienšu slimības specifiskās dzīvildzes rādītājiem, taču novēro tendenci uz labākiem dzīvildzes rādītājiem rs1550623 un rs17356907 nesējām homozigotiskā formā.
Pateicība
Pētījums izstrādāts Rīgas Stradiņa universitātes Onkoloģijas institūta Molekulārās ģenētikas laboratorijā Valsts pētījumu programmas “BIOMEDICINE 2014–2017” projekta Nr. 5.5. “Personalizēta vēža diagnostika un terapijas efektivitātes noteikšana” ietvaros.
Abstract
Genetic Risk Assessments of Multifactorial Breast Cancer
Breast cancer is a complex, multifactorial disease characterised by interaction of environmental and genetic risk factors. Low-penetrance allelic variants are the leading study object in breast cancer genetics. There is a variable frequency and predisposing effect strength observed among low-penetrance variants associated with breast cancer development. The aim of this study was to determine the association between 11 allelic variants and breast cancer morbidity in population of Latvia.
Genomic DNA from 2609 consecutive breast cancer patients and 694 healthy volunteer blood donors were analysed in this study. Genotyping of 11 allelic variants was done by RFLP and TaqMan probes. The results of genotyping and available clinical data were collected and processed using methods of statistical analysis.
There was a statistically significant association with breast cancer morbidity observed for seven out of eleven analysed variants. Five of them (rs9693444, rs1550623, rs13329835, rs3760982, rs7072776) showed breast cancer risk-increasing effect, whereas rs17356907 and rs1436904 – protective effect. Breast cancer risk-increasing effect was confirmed with rising number of risk alleles. There was no significant impact of analysed allelic variants on patients disease-specific survival rates.
Literatūra
- Berzina, D., Nakazawa-Miklasevica, M., Zestkova J., et al. BRCA1/2 mutation screening in high-risk breast/ovarian cancer families and sporadic cancer patient surveilling for hidden high-risk families. BMC Medical Genetics. 2013, 14, 61.
- Easton, D. F., Pooley, K. A., Dunning, A. M., et al. Genome-wide association study identifies novel breast cancer susceptibility loci. Nature. 2007, 447(7148), 1087–1093.
- Gardovskis, A., Irmejs, A., Miklasevics, E., et al. Clinical, molecular and geographical features of hereditary breast/ ovarian cancer in Latvia. Hereditary Cancer in Clinical Practice. 2005, 3(2), 71–76.
- Harlid, S., Ivarsson, M. I., Butt, S., et al. Combined effect of low-penetrant SNPs on breast cancer risk. British Journal of Cancer. 2012, 106(2), 389–396.
- Ledwoń, J. K., Hennig, E. E., Maryan, N., et al. Common low-penetrance risk variants associated with breast cancer in Polish women. BMC Cancer. 2013, 30, 13, 510.
- Lee, C. P., Irwanto, A., Salim, A., et al. Breast cancer risk assessment using genetic variants and risk factors in a Singapore Chinese population. Breast Cancer Research. 2014, 16(3), R64.
- Lichtenstein, P., Holm, N. V., Verkasalo, P. K., et al. Environmental and heritable factors in the causation of cancer – analyses of cohorts of twins from Sweden, Denmark, and Finland. The New England Journal of Medicine. 2000, 343(2), 78–85.
- Lobo, I. Multifactorial inheritance and genetic disease. Nature Education. 2008, 1(1), 5.
- Ma, J. and Jemal, A. Breast cancer metastasis and drug resistance. No: Progress and Prospects. A. Ahmad, ed. New York: Springer Science & Business Media, 2012, 416.
- Martin, A. M. and Weber, B. L. Genetic and hormonal risk factors in breast cancer. Journal of the National Cancer Institute. 2000, 92(14), 1126–1135.
- Michailidou, K., Beesley, J., Lindstrom. S., et al. Genome-wide association analysis of more than 120,000 individuals identifies 15 new susceptibility loci for breast cancer. Nature Genetics. 2015, 47(4), 373–380.
- Michailidou, K., Hall, P., Gonzalez-Neira, A., et al. Large-scale genotyping identifies 41 new loci associated with breast cancer risk. Nature Genetics. 2013, 45(4), 353–361.
- Pharoah, P. D. P., Antoniou, A. C., Easton, D. F., et al. Polygenes, risk prediction, and targeted prevention of breast cancer. New England Journal of Medicine. 2008, 358, 2796–2803.
- Thompson, D. and Easton, D. The genetic epidemiology of breast cancer genes. Journal of Mammary Gland Biology and Neoplasia. 2004, 9, 221–236.
- Turnbull, C., Ahmed, S., Morrison, J., et al. Genome-wide association study identifies five new breast cancer susceptibility loci. Nature Genetics. 2010, 42(6), 504–507.
- Zhang, B., Li, Y., Li, L., et al. Association study of susceptibility loci with specific breast cancer subtypes in Chinese women. Breast Cancer Research and Treatment. 2014, 146(3), 503–514.
- Zheng, W., Zhang, B., Cai, Q., et al. Common genetic determinants of breast-cancer risk in East Asian women: a collaborative study of 23 637 breast cancer cases and 25 579 controls. Human Molecular Genetics. 2013, 22(12), 2539–2550.



