Sliktas prognozes riska faktori hospitalizētiem pacientiem ar sadzīvē iegūtu pneimoniju
Sliktas prognozes riska faktori hospitalizētiem pacientiem ar sadzīvē iegūtu pneimoniju
Kopsavilkums
Ievads. Sadzīvē iegūta pneimonija (SIP) ir viens no biežākajiem nāves cēloņiem visā pasaulē.
Darba mērķis. Novērtēt mirstību, sliktas prognozes riska faktorus hospitalizētiem pacientiem ar SIP.
Materiāls un metodes. Pētījumā tika iekļauti Rīgas Austrumu klīniskās universitātes slimnīcas stacionārā “Gaiļezers” hospitalizētie pacienti ar SIP, kuri izrakstīti no stacionāra laikposmā no 2012. gada 1. septembra līdz 2013. gada 31. augustam. Tika analizēti šādi dati: vecums, dzimums, sistoliskais asinsspiediens (SAS), diastoliskais asinsspiediens (DAS), sirdsdarbības frekvence, apjukums, skābekļa saturācija asinīs (SpO2), leikocītu skaits, trombocītu skaits, C-reaktīvā olbaltuma (CRO) līmenis, glikēmija, radioloģiskās izmaiņas, stacionēšana intensīvās terapijas nodaļā (ITN). Lineārie dati atainoti ar vidējām vērtībām ± standartdeviāciju (SD), ja tie atbilda normālsadalījumam, vai mediānu un amplitūdu, ja neatbilda normālsadalījumam.
Rezultāti. Pētījumā tika iekļauti 358 pacienti, miris 71 (19,8 %) pacients. Mirušo vidējais vecums bija 74,0 gadi [18], izārstēto – 66,0 [29] gadi, p = 0,003.
Vidējais SAS mirušajiem (± SD) bija 113,2 ± 30,2 mm Hg, izārstētajiem – 133,9 ± 22,9 mm Hg, p < 0,001. Vidējais DAS mirušajiem (± SD) bija 63,8 ± 18,7 mm Hg, izārstētajiem – 74,7 ± 13,6 mm Hg, p < 0,001. Vidējais SpO2 mirušajiem bija 91 % [14], izārstētajiem – 94 % [4], p < 0,001. Vidējais CRO līmenis mirušajiem bija 238,90 mg/l [216,04], izārstētajiem – 150,1 mg/l [198,80], p = 0,001. Vidējais trombocītu skaits mirušajiem bija 198,0 × 103/l [182], izārstētajiem – 234,0 × 103/l [127], p = 0,009. Vidējais glikozes līmenis mirušajiem – 7,50 mmol/l [4,30], izārstētajiem – 7,00 mmol/l [2,41], p = 0,759. Abpusēja pneimonija – 30 (42,3 %) mirušajiem, 53 (18,6 %) izārstētajiem, p < 0,001, apjukums – 44 (62,0 %) mirušajiem, 23 (8,0 %) izārstētajiem pacientiem, p < 0,001.
Loģistiskajā regresijā neatkarīgi riska faktori bija SpO2 – p = 0,014, stacionēšana ITN – p = 0,001, apjukums – p < 0,001, vecums ≥ 65 gadiem – p = 0,013.
Secinājumi. Pacientiem ar SIP neatkarīgi sliktas prognozes riska faktori bija zemāks SpO2, apjukums, stacionēšana ITN un vecums ≥ 65 gadiem.
Ievads
Sadzīvē iegūta pneimonija (SIP) ir galvenais nāves cēlonis infekcijas slimību vidū Eiropā. Pēc Pasaules Veselības organizācijas (PVO) datiem dziļo elpceļu infekcijas ieņēma 5. vietu nāves cēloņu vidū Eiropā 2010. gadā – 0,23 miljoni (2,3 %) no visiem mirušajiem. Saslimstība un mirstība no SIP pieaug līdz ar pacientu vecumu, īpaši augsts risks ir pacientiem pēc 65 gadu vecuma. Ņemot vērā pieaugošo populācijas vecumu, SIP aktualitāte un ārstēšanas izmaksas, visticamāk, turpmāko gadu laikā tikai pieaugs [Lozano, 2012; Kothe, 2008].
Aizdomas par SIP rodas, ja pacientam ir akūts klepus, vismaz viena jauna fokālā krūškurvja izmeklēšanas pazīme (perkutors pieslāpējums, bronhiāla elpošana, krepitācija), paaugstināta temperatūra ilgāk nekā četras dienas un dispnoja / tahipnoja, ko nevar izskaidrot ar citiem iemesliem. Pierādīta SIP ir, ja minētās pazīmes un krūškurvja rentgenogrammā (Rtg) konstatēts no jauna radies aizēnojums [Woodhead, 2011].
Vidējā SIP incidence Eiropas valstīs ir 1,54–1,7 uz 1000 iedzīvotājiem, tomēr precīzi dati par slimību daudzās valstīs, tostarp arī Latvijā, nav pieejami. Tas tāpēc, ka SIP gadījumi tiek atšķirīgi reģistrēti, turklāt SIP kā diagnoze nav iekļauta Starptautiskajā slimību klasifikācijā (SSK-10) [Torres, 2013].
Pieejamie dati liecina, ka lielākā daļa pacientu ar SIP tiek ārstēti ambulatori. Hospitalizēto pacientu īpatsvars ir no 20 līdz 50 %. Hospitalizēti tiek gados vecāki pacienti, pacienti ar blakusslimībām, kā arī pacienti ar smagas norises SIP. Pēdējo gadu laikā novērots pieaugošs hospitalizēto pacientu īpatsvars [Trotter, 2008; Singanayam, 2014].
Pētījumi atklāj, ka hospitalizēto pacientu mirstība dažādos reģionos ir atšķirīga. Vidēji mirstība sasniedz 5–15 %, pat 40 % intensīvās terapijas nodaļās (ITN) [Gibson, 2013; Blasi, 2010]. Vidēji hospitalizēto pacientu īpatsvars ITN Eiropā variē no < 5 % Itālijā līdz > 10 % Beļģijā. Tas liek secināt, ka lielākā daļa pacientu, kas nomirst no SIP, nomirst ārpus ITN [Bauer, 2012].
Latvijā 2012. gadā no pneimonijas miruši 343 pacienti, mirstība novērota vecuma grupā no 15 līdz 59 gadiem – 9,3 uz 100 000 iedzīvotāju, vecuma grupā virs 60 gadiem – 45,0 uz 100 000 iedzīvotāju [Slimību profilakses un kontroles centrs, 2013]. Tomēr pieejamie dati apkopo kopējo mirstību no pneimonijas, neprecizējot pneimonijas paveidu – sadzīvē iegūtas pneimonijas, hospitālas pneimonijas, pneimonijas pacientiem ar imūnsupresiju, kā arī neprecizējot pneimonijas diagnozes noteikšanas veidu.
Darba mērķis
Izvērtēt mirstību un sliktas prognozes riska faktorus hospitalizētiem pacientiem ar radioloģiski pierādītu sadzīvē iegūtu pneimoniju.
Materiāls un metodes
klasificējams kā retrospektīvs gadījumu sēriju pētījums. Tajā tika iekļauti pacienti ar radioloģiski apstiprinātu SIP, kuri ārstēti un izrakstīti no Rīgas Austrumu klīniskās universitātes slimnīcas (RAKUS) stacionāra “Gaiļezers” laikposmā no 2012. gada 1. septembra līdz 2013. gada 31. augustam.
No pētījuma tika izslēgti:
- pacienti, kuriem SIP diagnoze noteikta klīniski bez radioloģiska pamatojuma;
- pacienti ar hospitālu pneimoniju;
- imūnsupresēti pacienti, tostarp AIDS slimnieki, pacienti, kuri saņem imūnsupresīvu terapiju, kas atbilst vismaz 15 mg prednizolona dienā.
Pētījuma datu iegūšanai tika izmantotas medicīniskās slimības kartes. Tika analizēti epidemioloģiskie dati. Objektīvās atrades dati – sirdsdarbības frekvence, sistoliskais asinsspiediens (SAS), diastoliskais asinsspiediens (DAS), skābekļa saturācija asinīs (SpO2), apjukums – tika analizēti, izmantojot ierakstus no uzņemšanas nodaļas primārās apskates kartes.
Laboratoriskie dati – kopējais leikocītu skaits, neitrofilo leikocītu skaits, trombocītu skaits, C-reaktīvā olbaltuma (CRO) un glikozes līmenis – tika analizēti iestāšanās dienā.
Radioloģiskie izmeklējumi tika analizēti iestāšanās dienā.
Iegūtie dati tika izanalizēti ar programmām Microsoft Excel un SPSS for Windows. Lineāro datu sadalījuma atbilstība normālsadalījumam tika pārbaudīta, izmantojot Kolmogorova-Smirnova un Šapiro- Vilka testu. Ja p vērtība bija lielāka par 0,05, dati atbilda normālsadalījumam un datu vidējās vērtības tika raksturotas ar vidējo vērtību un standartdeviāciju (SD). Ja p vērtība bija mazāka par 0,05, dati neatbilda normālsadalījumam un vidējo rādītāju raksturojumam tika izmantota mediāna un starpkvartiļu izkliede jeb amplitūda, kas attēlota kvadrātiekavās. Mirušo un izārstēto pacientu vidējo datu salīdzināšanai tika lietots ANOVA tests, ja dati atbilda normālsadalījumam, un Manna-Vitnija tests, ja dati neatbilda normālsadalījumam. Fišera tests un hī kvadrāta tests tika lietots mirušo un izārstēto pacientu kvalitatīvo pazīmju salīdzināšanai. Sliktas prognozes neatkarīgo riska faktoru noteikšanai tika izmantota loģistiskās regresijas analīze. Dati tika uzskatīti par statistiski ticamiem, ja ticamības intervāls jeb p vērtība bija mazāka par 0,05.
Pētījuma veikšanai tika saņemta Rīgas Stradiņa universitātes Ētikas komisijas atļauja.
Rezultāti
Pētījumā tika iekļauti 358 pacienti ar radioloģiski apstiprinātu SIP. Vairāk nekā puse saslimušo bija vīrieši – 202 (56 %). Miris 71 (19,8 %) pacients, no kuriem 37 (52,1 %) bija vīrieši. Septiņdesmit (19,6 %) pacienti tikuši stacionēti intensīvās terapijas nodaļā (ITN), no tiem 37 (53 %) miruši. No visiem mirušajiem pacientiem 40 (56 %) miruši pirmo 48 stundu laikā.
Normālsadalījumam atbilda šādi lineārie dati: SAS, DAS. Tādi dati kā vecums, SpO2, sirdsdarbības frekvence, kopējais leikocītu skaits, neitrofilo leikocītu skaits, trombocītu skaits, CRO un glikozes līmenis neatbilda normālsadalījumam.
Pacientu vidējais vecums bija 68,0 [28] gadi, vecuma diapazons – no 18 līdz 100 gadiem. Mirušo un izārstēto pacientu iedalījums pa vecuma grupām parādīja, ka visaugstākais izārstēto un mirušo pacientu īpatsvars bijis vecuma grupā no 71 līdz 80 gadiem, 29 (8,1 %) mirušie un 64 (17,9 %) izārstētie pacienti, starpība starp grupām statistiski ticama, p = 0,025 (sk. 1. att.).
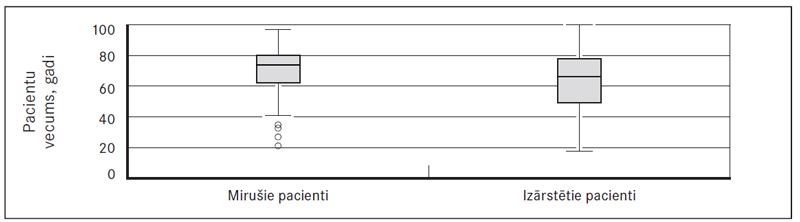
Pacientu vidējais vecums tika iegūts, salīdzinot vecumu mirušo un izārstēto pacientu grupās. Mirušo pacientu vidējais vecums bija 74,0 [18] gadi, izārstēto – 66,0 [29] gadi, atšķirība starp grupām ir statistiski ticama, p = 0,003 (sk. 2. att.).
No visiem hospitalizētajiem pacientiem 202 (56,4 %) bija ≥ 65 gadu vecumā, mirušo grupā – 70,4 % (50 pacienti), izārstēto grupā – 53,0 % (152 pacienti), atšķirība starp grupām ir statistiski ticama, p = 0,011.
Pētījumā tika analizēti SAS un DAS rādītāji, tie tika salīdzināti abās grupās. Vidējais SAS iestāšanās brīdī mirušajiem pacientiem (± SD) bija 113,2 ± 30,2 mm Hg, izārstētajiem – 133,9 ± 22,9 mm Hg, atšķirība starp grupām ir statistiski ticama, p < 0,001. Vidējais DAS stacionēšanas brīdī mirušajiem pacientiem (± SD) bija 63,8 ± 18,7 mm Hg, izārstētajiem – 74,7 ± 13,6 mm Hg, atšķirība starp grupām ir statistiski ticama, p < 0,001.
1. attēls. Mirušo un izārstēto pacientu iedalījums pa vecuma grupām / Distribution of the cured and dead patients within the age groups

Vidējā sirdsdarbības frekvence mirušajiem pacientiem bija 99,5 [30] reizes minūtē, izārstētajiem pacientiem – 94,0 [25] reizes minūtē, atšķirība starp grupām nav statistiski ticama, p = 0,097.
Apjukums stacionēšanas brīdī ticis konstatēts 67 (18,7 %) pacientiem. Salīdzinot abas grupas, apjukums ticis konstatēts 44 (62 %) mirušo pacientu un tikai 23 (8 %) izārstēto grupā, atšķirība starp grupām ir statistiski ticama, p < 0,001.
SpO2 dati tika analizēti un vidējie rādītāji salīdzināti abās grupās. Vidējais SpO2 mirušo pacientu grupā bija 91 [14] %, izārstēto pacientu grupā – 94 [4] %, atšķirība starp grupām ir statistiski ticama, p < 0,001.
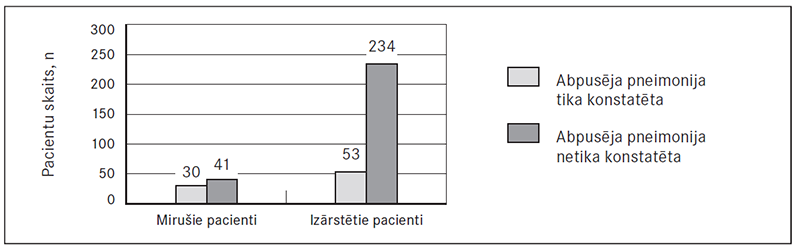
Kā viens no prognozes riska faktoriem tika izvērtēta radioloģiski konstatēta abpusēja pneimonija stacionēšanas brīdī. Rentgenoloģiski apstiprināta abpusēja pneimonija konstatēta 83 (23 %) pacientiem. Mirušo pacientu vidū – 30 (42 %), izdzīvojušo – 53 (18 %), atšķirība starp grupām ir statistiski ticama, p < 0,001 (sk. 3. att.).
Pētījumā tika analizēts kopējais leikocītu skaits, neitrofilie leikocīti un trombocīti. Dati salīdzināti abās grupās.
Vidējais kopējais leikocītu skaits bija 10,32 [7,52] × 109/l, mirušo pacientu grupā – 8,89 [8,65] × 109/l, izārstēto pacientu grupā – 10,75 [6,85] × 109/l, atšķirība starp grupām ir statistiski ticama, p = 0,001.
Vidējais neitrofilo leikocītu skaits stacionētajiem pacientiem bija 8,41 [6,43] × 109/l, mirušo pacientu grupā – 7,07 [7,70] × 109/l, izārstēto pacientu grupā – 8,60 [6,75] × 109/l, atšķirība starp grupām ir statistiski ticama, p = 0,023.
Vidējais trombocītu skaits hospitalizētajiem pacientiem bija 230,0 [136] × 103/l, mirušo pacientu grupā – 198,0 [182] × 103/l, izārstēto pacientu grupā – 234,0 [127] × 103/l, atšķirība starp grupām ir statistiski ticama, p = 0,009.
Pētījumā tika noteikts arī CRO līmenis, salīdzināti vidējie rādītāji abās grupās. Vidējais CRO līmenis hospitalizētajiem pacientiem bija 171,60 [202,85] mg/l, mirušo pacientu grupā – 238,90 [216,04] mg/l, izārstēto pacientu grupā – 150,10 [198,80] mg/l, atšķirība starp grupām ir statistiski ticama, p = 0,001.
Tika salīdzināti arī vidējie glikēmijas rādītāji abās grupās. Vidējais glikēmijas rādītājs hospitalizētajiem pacientiem bija 6,97 [2,75] mmol/l, mirušo pacientu grupā – 7,50 [4,30] mmol/l, izārstēto pacientu grupā – 7,00 [2,41] mmol/l, atšķirība starp grupām nav statistiski ticama, p = 0,759.
Mirušo un izārstēto pacientu pētījuma rādītāji apkopoti un parādīti 1. tabulā.
2. attēls. Mirušo un izārstēto pacientu vidējais vecums / Comparison of mean age within dead and cured patients
3. attēls. Abpusēja pneimonija mirušajiem un izārstētajiem pacientiem / Comparison of bilateral pneumonia within dead and cured patients
1. tabula. Pētījumā iegūto rādītāju par mirušajiem un izārstētajiem pacientiem salīdzinājums / Summary of studied features within dead and cured patients
| Rādītājs | Mirušie pacienti | Izārstētie pacienti | Statistiskā ticamība, p |
|---|---|---|---|
| Vidējais vecums, gadi | 74,0 [18]* | 66,0 [29] | 0,003 |
| Vecums ≥ 65 gadiem, n (%) | 50 (70) | 152 (53) | 0,011 |
| Vidējais SAS ± SD, mm Hg | 113,2 ± 30,2 | 133,9 ± 22,9 | < 0,001 |
| Vidējais DAS ± SD, mm Hg | 63,8 ± 18,7 | 74,7 ± 13,6 | < 0,001 |
| Vidējā sirdsdarbības frekvence, reizes minūtē | 99,5 [30] | 94,0 [25] | 0,097 |
| Apjukums, n (%) | 44 (62) | 23 (8) | < 0,001 |
| Vidējais SpO2, % | 91 [14] | 94 [4] | < 0,001 |
| Abpusēja pneimonija, n (%) | 30 (42) | 53 (18) | < 0,001 |
| Stacionēts ITN, n (%) | 37 (53) | 33 (12) | < 0,001 |
| Leikocītu skaits, 109/l | 8,89 [8,65] | 10,75 [6,85] | 0,001 |
| Neitrofilo leikocītu skaits, 109/l | 7,07 [7,70] | 8,60 [6,75] | 0,023 |
| Trombocītu skaits, 103/l | 198,0 [182] | 234,0 [127] | 0,009 |
| CRO līmenis, mg/l | 238,90 [216,04] | 150,10 [198,80] | 0,001 |
| Glikozes līmenis, mmol/l | 7,50 [4,30] | 7,00 [2,41] | 0,759 |
* Ja p < 0,05, dati neatbilda normālsadalījumam un vidējo rādītāju raksturojumam tika izmantota mediāna un starpkvartiļu izkliede jeb amplitūda, kas attēlota kvadrātiekavās.
SAS – sistoliskais asinsspiediens, DAS – diastoliskais asinsspiediens, SD – standartdeviācija, SpO2 – skābekļa saturācija asinīs, CRO – C reaktīvais olbaltums, ITN – intensīvās terapijas nodaļa.
2. tabula. Sliktas prognozes riska faktoru loģistiskās regresijas koeficienti, to statistiskās ticamības novērtējums / Coefficients of logistic regression, statistical significance within poor prognosis risk factors
| Sliktas prognozes riska faktori | Mainīgie vienādojumā | |||||
|---|---|---|---|---|---|---|
| Regresijas konstante | Standartkļūda | Valda (Wald) koeficients | Brīvības pakāpju skaits | p vērtība | Iespējamību attiecība | |
| Dzimums | 0,475 | 0,456 | 1,085 | 1 | 0,298 | 1,608 |
| Vecums | 0,015 | 0,022 | 0,481 | 1 | 0,488 | 1,015 |
| SAS | 0,016 | 0,012 | 1,790 | 1 | 0,181 | 1,016 |
| DAS | 0,011 | 0,021 | 0,286 | 1 | 0,593 | 1,011 |
| SPO2 | 0,061 | 0,025 | 6,099 | 1 | 0,014 | 1,063 |
| Sirdsdarbības frekvence | −0,006 | 0,009 | 0,437 | 1 | 0,508 | 0,994 |
| Leikocīti | 0,102 | 0,210 | 0,236 | 1 | 0,627 | 1,107 |
| Neitrofilie leikocīti | −0,011 | 0,217 | 0,002 | 1 | 0,961 | 0,989 |
| Trombocīti | 0 | 0,002 | 0,026 | 1 | 0,872 | 1,000 |
| CRO | 0 | 0,002 | 0,206 | 1 | 0,650 | 0,999 |
| ITN | 2,227 | 0,642 | 12,016 | 1 | 0,001 | 9,271 |
| Abpusēja pneimonija | 0,130 | 0,500 | 0,068 | 1 | 0,795 | 1,139 |
| Apjukums | 2,815 | 0,467 | 36,357 | 1 | 0 | 16,690 |
| Glikoze | −0,070 | 0,039 | 3,131 | 1 | 0,077 | 0,933 |
| Vecums ≥ 65 gadi | −2,161 | 0,873 | 6,130 | 1 | 0,013 | 0,115 |
| Konstante | −13,587 | 3,429 | 15,701 | 1 | 0 | 0 |
SAS – sistoliskais asinsspiediens, DAS – diastoliskais asinsspiediens, SpO2 – skābekļa saturācija asinīs, CRO – C reaktīvais olbaltums, ITN – intensīvās terapijas nodaļa.
Visi minētie rādītāji tika iekļauti loģistiskās regresijas analīzē, lai precizētu, kuri sliktas prognozes riska faktori ir neatkarīgi riska faktori. Izveidotā modeļa konstante ir statistiski ticama, p < 0,001. Loģistiskās regresija datu analīzē neatkarīgie riska faktori bija: SpO2 – p = 0,014, stacionēšana ITN – p = 0,001, apjukums stacionēšanas brīdī – p < 0,001, vecums ≥ 65 gadiem – p = 0,013. Iegūtie dati apkopoti 2. tabulā.
Izveidotais loģistiskās regresijas modelis spēja paredzēt 88,2 % no visiem notikumiem. Iegūtie dati atspoguļoti 3. tabulā.
3. tabula. Paredzamo notikumu skaits / Predicted cases
| Novērotie notikumi | Paredzamie notikumi | ||
|---|---|---|---|
| Mirušo pacientu skaits, n | Dzīvo pacientu skaits, n | Pareizo prognožu skaits, % | |
| Mirušo pacientu skaits, n | 37 | 23 | 61,7 |
| Dzīvo pacientu skaits, n | 12 | 225 | 94,9 |
| Kopējais pareizo prognožu skaits, % | — | — | 88,2 |
Diskusija
Pētījuma laikā tika konstatēts, ka mirstība sasniedza 19,8 %. Eiropā dažādās valstīs veiktajos pētījumos redzams, ka hospitalizēto pacientu mirstība ir izteikti variabla, vidēji līdz 15 %. Pētījumus savstarpēji salīdzināt ir grūti to dažādā dizaina dēļ. Ņemot vērā vidējos datus, var apgalvot, ka šā pētījuma izstrādes laikā tika konstatēta samērā augsta mirstība. Turklāt 70 (19,6 %) pacienti tikuši stacionēti ITN. Pieejamie dati liecina, ka Eiropā procentuāli vidēji tikai 5–10 % tiek stacionēti ITN [Gibson, 2013]. Tas liek domāt, ka šajā pētījumā aplūkotie hospitalizētie pacienti ir bijuši klīniski “smagāki”, tāpēc procentuāli lielāks skaits ir stacionēti ITN un attiecīgi arī mirstība ir bijusi augstāka. Turklāt vairāk nekā puse mirušo pacientu – 40 (56 %) – nomira pirmo 48 stundu laikā.
Kā viens no galvenajiem sliktas prognozes riska faktoriem daudzos pētījumos ir pierādīts vidējais vecums, īpaši vecums ≥ 65 gadiem, kas kā atsevišķs riska faktors ir iekļauts arī CRB65 (C – confusion, R – respiratory rate, B – blood pressure) un CURB65 (C – confusion, U – urea, R – respiratory rate, B – blood pressure) pneimonijas smaguma novērtējuma skalā [McNally, 2010]. Mūsu pētījumā tika konstatēts, ka mirušie pacienti bija statistiski ticami vecāki par izārstētajiem pacientiem. Vairāk nekā puse no pētījumā iekļautajiem pacientiem – 202 (56,4 %) – bija vecuma grupā ≥ 65 gadiem.
Starptautiski veiktos pētījumos kā neatkarīgi sliktas prognozes riska faktori konstatēti, piemēram, vecums ≥ 65 gadiem un blakusslimības [Ishiguro, 2013]. Mūsu pētījumā konstatēts, ka vecums ≥ 65 gadiem arī bija neatkarīgs sliktas prognozes riska faktors. Blakusslimības pētījumos tiek minētas kā svarīgs pneimonijas smaguma kritērijs un mirstības riska faktors, tomēr mūsu pētījumā tās netika iekļautas trūkstošo datu dēļ, īpaši mirušo pacientu grupā, jo viņu anamnēzes datu iegūšana bija apgrūtināta smagā stāvokļa dēļ. Minēto datu iegūšanu apgrūtina arī fakts, ka Latvijā nav vienotas pacientu datu bāzes, kas ļautu precizēt informāciju par pacientiem, īpaši par tiem, kuri tiek stacionēti vispārēji smagā stāvoklī, ar ierobežotu kontaktu.
Starptautiskos pētījumos citi neatkarīgi sliktas prognozes riska faktori, kas asociēti ar mirstību, ir stacionēšana ITN, bilaterāla pneimonija, pleirīts, apjukums stacionēšanas brīdī, bakteriēmija, neefektīva sākotnējā terapija [Sintes, 2014]. Mūsu pētījumā tika konstatēts, ka neatkarīgi sliktas prognozes riska faktori bija stacionēšana ITN un apjukums stacionēšanas brīdī.
Pētījumā gūtie rezultāti parādīja, ka mūsu pacientiem sliktas prognozes riska faktori ir tādi paši kā iepriekš veiktos starptautiskos pētījumos un tie ir iekļauti pneimonijas smaguma izvērtēšanas skalās [Aujesky, 2005]. Pneimonijas smaguma izvērtēšanas skalas ļauj apzināties “smagākos” pacientus, lemt par turpmākās ārstēšanas nepieciešamību ITN, kā arī atkarībā no pacientu slimības smaguma pakāpes sākt atbilstošu antibakteriālo terapiju [Yandiola, 2009].
Latvijā netiek plaši lietotas pneimonijas smaguma pakāpes izvērtēšanas skalas. Arī šajā pētījumā slimības smaguma skalas netika iekļautas pacientu izvērtēšanā trūkstošo datu dēļ. Tomēr to ieviešana ļautu precīzāk novērtēt stacionēto pacientu slimības smagumu, ļautu prognozēt mirstību, kā arī izvēlēties piemērotāku antibakteriālo terapiju atkarībā no slimības smaguma pakāpes. Savukārt piemērotas antibakteriālās terapijas izvēle atbilstoši reģionālajām vadlīnijām ļautu samazināt mirstību un komplikāciju biežumu [McCabe, 2009].
Secinājumi
Hospitalizētajiem pacientiem mirstība no sadzīvē iegūtas pneimonijas bija samērā augsta – 19,8 %.
Mirušie pacienti bija vecāki, stacionēšanas brīdī klīniski “smagāki” – ar zemāku sistolisko un diastolisko asinsspiedienu, apjukumu stacionēšanas brīdī un zemāku skābekļa saturāciju asinīs.
Neatkarīgi sliktas prognozes riska faktori hospitalizētiem pacientiem ar SIP bija: zemāks SpO2 stacionēšanas brīdī, apjukums stacionēšanas brīdī, vecums ≥ 65 gadiem, kā arī nepieciešamība pacientu stacionēt ITN smagās pneimonijas norises dēļ.
Abstract
Poor Prognosis Risk Factors for Hospitalised Patients with Community Acquired Pneumonia
Community acquired pneumonia (CAP) is one of the leading causes of death worldwide.
The aim of the study was to establish the mortality within hospitalised patients with CAP and the main risk factors of mortality.
This was a retrospective study of CAP patients, who were hospitalised at Rīga Eastern Clinical University Hospital, Clinic Gailezers between September 1, 2012 and August 31, 2013. Following data were analysed: age, sex, systolic blood pressure (SBP), diastolic blood pressure (DBP), heart rate, confusion, blood oxygen saturation (SpO2), leukocyte count, thrombocyte count, C-reactive protein (CRP) levels, blood glucose levels, radiological findings, hospitalisation in intensive care unit (ICU). Linear data are shown using mean ± standard deviation (SD) or median and interquartile range depending on tests of normality.
358 patients met the inclusion criteria. Total mortality was 71 (19.8 %) patients. These patients were older than the cured ones (74.0 [18] vs. 66.0 [29] years, p = 0.003), had a lower SBP (113.2 ± 30.2 (SD) vs. 133.9 ± 22.9 (SD) mmHg, p < 0.001), lower DBP (63.8 ± 18.7 (SD) vs. 74.7 ± 13.6 (SD) mmHg, p < 0.001), lower SpO2 (91 [14] vs. 94 [4] %, p < 0.001). Dead patients had higher mean CRP levels (238.90 [216.04] vs. 150.1 [198.80] mg/L, p = 0.001), lower mean thrombocyte count (198.0 [182] vs. 234.0 [127] × 103/L, p = 0.009), higher mean glucose levels (7.50 [4.30] vs. 7.00 [2.41] mmol/L, p = 0.759). Bilateral infiltrates were confirmed in 30 (42.3 %) of dead patients and in 53 (18.6 %) of cured patients, p < 0.001, confusion – in 44 (62.0 %) of dead patients and in 23 (8.0 %) of cured patients, p < 0.001. Logistic regression showed that poor prognosis risk factors were SpO2 – p = 0.014, hospitalisation in ICU – p = 0.001, confusion – p < 0.001, age ≥ 65 years – p = 0.013.
Our study showed that independent poor prognosis risk factors were lower SpO2, confusion, age ≥ 65 years and hospitalisation in ICU.
Literatūra
- Slimību profilakses un kontroles centrs. Latvijas veselības aprūpes statistikas gadagrāmata 2012. Mirstība // www.spkc.gov.lv/veselibas-aprupes-statistika (sk. 10.05.2014.).
- Aujesky D., Auble T. E., Yealy D. M., et al. Prospective comparison of three validated prediction rules for prognosis in community-acquired pneumonia // The American Journal of Medicine, 2005; 118 (4): 384–392.
- Bauer T. T., Welte T., Strauss R., et al. Why do nonsurvivors from community-acquired pneumonia not receive ventilatory support? // Lung, 2013; 191 (4): 417–424.
- Blasi F., Mantero M., Santus P., Tarsia P. Understanding the burden of pneumococcal disease in adults // Clinical Microbiology and Infection, 2012; 18 (5): 7–14.
- Gibson G. J., Loddenkemper R., Sibille Y. Acute lower respiratory infections // The European Lung White Book, 2013; 210–223.
- Ishiguro T., Takayanagi N., Yamaguchi S., et al. Etiology and factors contributing to the severity and mortality of community-acquired pneumonia // Internal Medicine, 2013; 52 (3): 317–324.
- Kothe H., Bauer T., Marre R., et al. Outcome of community-acquired pneumonia: influence of age, residence status and antimicrobial treatment // European Respiratory Journal, 2008; 32 (1): 139–146.
- Lozano R., Naghavi M., Foreman K., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010 // The Lancet, 2012; 380 (9859): 2095–2128.
- McCabe C., Kirchner C., Zhang H., et al. Guideline-concordant therapy and reduced mortality and length of stay in adults with community-acquired pneumonia // Archives of Internal Medicine, 2009; 169 (16): 1525–1531.
- McNally M., Curtain J., O’Brien K. K., et al. Validity of British Thoracic Society guidance (the CRB–65 rule) for predicting the severity of pneumonia in general practice: systematic review and meta-analysis // The British Journal of General Practice, 2010; 60 (579): 423–433.
- Singanayam A., Chalmers D. J., Welte T. Epidemiology of CAP in Europe // European Respiratory Monograph – Current issue: Community-Acquired Pneumonia / Ed. by Welte T. European Respiratory Society. 2014; (63): 1–9.
- Sintes H., Sibilla O., Watere G. W., et al. Severity assessment tools in CAP // European Respiratory Monograph – Current issue: Community-Acquired Pneumonia / Ed. by Welte T. European Respiratory Society, 2014; (63): 88–104.
- Torres A., Peetermans W. E., Viegi G., Blasi F. Risk factors for community-acquired pneumonia in adults in Europe: a literature review // Thorax, 2013; 68 (11): 1057–1065.
- Trotter C. L., Stuart J. M., George R., Miller E. Increasing hospital admissions for pneumonia, England // Emerging Infectious Diseases, 2008; 14 (5): 727–733.
- Yandiola P. P. E., Capelastegui A., Quintana J., Diez R., et. al. Prospective comparison of severity scores for predicting clinically relevant outcomes for patients hospitalized with community-acquired pneumonia // Chest, 2009; 135 (6): 1572–1579.
- Woodhead M., Blasi F., Ewig S., et al. Guidelines for the management of adult lower respiratory tract infection // Clinical Microbiology and Infection, 2011; 17 (6): 1–24.



